栏目导航
Inmazeb中文说明书 治疗埃博拉病毒感染
发表时间: 2024-06-12 04:02:42 作者: 稀释液
2020年10月14日,再生元(Regeneron)近日宣布,美国食品药品监督管理局(FDA)已批准Inmazeb(atoltivimab、maftivimab、odesivimab-ebgn,前称REGN-EB3)用来医治埃博拉病毒感染,该药是一款三抗体鸡尾酒疗法,是由3种全人IgG1单抗组成的混合物,用来医治由扎伊尔型埃博拉病毒(Zaire ebolavirus)引起的感染,该药可用于成人和儿童感染者,包括感染检测呈阳性母亲的新生儿。
Inmazeb获得了治疗埃博拉病毒感染的孤儿药称号,此外,还授予Inmazeb突破性疗法指定用来医治扎伊尔埃博拉病毒感染。
稀释前,请将Inmazeb西林瓶冷藏在2°C至8°C的原装纸盒中,防止其受光线照射,不要冷冻或振摇。
Inmazeb是扎伊尔埃博拉病毒糖蛋白导向的人类单克隆抗体的组合,用来医治扎伊尔埃博拉病毒在成人和儿童患者中引起的感染,包括扎伊尔埃博拉病毒感染RT-PCR阳性母亲所生的新生儿。Inmazeb对埃博拉病毒和马尔堡病毒属的其他物种的疗效尚未确定。扎伊尔埃博拉病毒可能会跟着时间的推移而变化,出现抗药性或病毒毒力变化等因素可能会削弱抗病毒药物的临床益处。在决定是不是使用Inmazeb时,请考虑有关扎伊尔埃博拉病毒流行株药敏模式的现有信息。
必须在医生的监督下进行给药准备。在给药前应目视检查颗粒物和变色情况。Inmazeb应该是透明到微乳白色的,无色到淡黄色的溶液,没有可见的颗粒。如果溶液浑浊、变色或含有颗粒物,请丢弃药物。
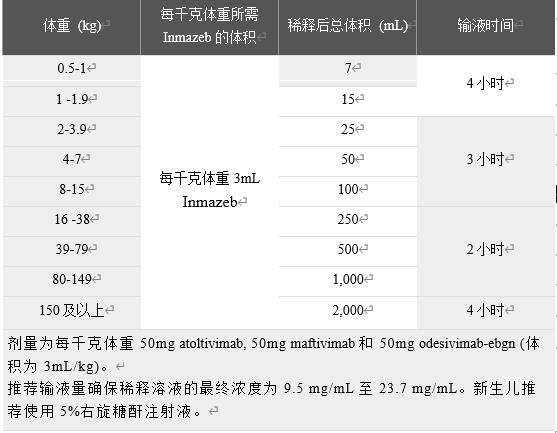
根据计算的体积剂量(ML)确定所需的瓶数。请参阅表2,以确定根据每个患者的体重(Kg)计算的Inmazeb体积(ML)。在大多数情况下要多瓶Inmazeb药物,每瓶含有14.5mL的Inmazeb溶液。例如,对于一个50公斤的患者,需要的Inmazeb体积是150mL (即11瓶)。
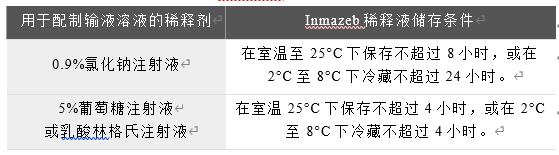
不要摇晃药瓶。在静脉输液前,必须将Inmazeb进一步稀释在包含0.9%氯化钠注射液(USP)、5%葡萄糖注射液(USP)或乳酸林格雷注射液(USP)的静脉聚氯乙烯输液袋中。对于新生儿,Inmazeb溶液应稀释于5%右旋糖酐注射液(USP)。
根据患者的体重选择适当体积的稀释液输液袋。从袋子中取出并丢弃相当于计算出的Inmazeb体积剂量(mL)的稀释液。然后将计算出的Inmazeb药物体积添加到袋子中。例如,对于50公斤的患者,从500mL输液袋中取出并丢弃150mL稀释剂。然后加入150mL的Inmazeb,获得总输液量500mL。通过温和的倒置混合稀释的溶液,不要振摇。
Inmazeb必须由医生给药,将稀释的输液溶液在给药前降至室温,通过无菌、附加0.2微米过滤器的静脉输液管路静脉注射稀释药液。
输液速率是根据患者的体重和输液量计算的。根据患者的体重遵循表2中概述的输液时间。
如果患者出现任何与输液相关的事件或其他不良事件的迹象,应该会减慢输液速度或中断输液。
不要将其他药物与Inmazeb混合,当通过同一输液管道同时给药其他药物时,尚未进行详尽的配伍研究。
Inmazeb输注期间和输注后的过敏反应包括输液相关事件已有报道。这些可能包括输液过程中和输液后的急性危及到生命的反应。在Inmazeb输液期间和之后,监测所有患者的体征和症状,包括但不限于低血压、寒战和发热。在发生严重或危及到生命的过敏反应的情况下,立马停止使用Inmazeb,并进行急救。在接受Inmazeb治疗的受试者中,有1%的人因输液相关不良事件而没办法完成输液。如果患者出现任何与输液相关的事件或其他不良事件的迹象,Inmazeb的输注速度可能会减慢或中断。
Inmazeb的非临床毒理学:致癌、诱变、致癌性、遗传毒性和生育研究尚未进行。
严禁对Inmazeb或其任何赋形剂过敏的患者使用该药物,药物所含成分见后文的一般描述。
没有使用Inmazeb在人类受试者中进行疫苗-治疗相互作用研究。然而,由于Inmazeb有可能抑制用于预防扎伊尔埃博拉病毒感染的活疫苗病毒的复制,并可能降低疫苗的效力,因此在使用Inmazeb治疗期间避免同时接种活疫苗。Inmazeb治疗开始后,两次活疫苗接种之间的间隔应符合当前的疫苗接种指南。
扎伊尔埃博拉病毒感染对母亲和胎儿都有生命威胁,不应因怀孕而停止治疗。现有数据表明,产妇和胎儿/新生儿发病率很高,这与发表的关于潜在的扎伊尔埃博拉病毒感染风险的文献一致。这一些数据不足以评估与药物相关的重大出生缺陷、流产或不良母婴结局的风险。用Inmazeb进行的动物繁殖研究还不进行。人类单克隆抗体,如Inmazeb,能够最终靠胎盘转运;因此,Inmazeb有可能从母亲转移到发育中的胎儿。临床考虑与疾病相关的母亲和/或胚胎/胎儿风险在感染扎伊尔埃博拉病毒的孕妇中,母亲、胎儿和新生儿的结局很差。大多数此类怀孕会导致产妇死亡,并伴有流产、死产或新生儿死亡,因此治疗不应因怀孕而停止。
建议确诊为扎伊尔埃博拉病毒感染的患者不要母乳喂养婴儿,以降低扎伊尔埃博拉病毒感染的出生后传播风险。没有数据表明母乳中是否含有Inmazeb,或对母乳喂养的婴儿有什么影响,或者对泌乳有什么影响。已知母体IgG可以存在于母乳中,在母乳喂养的婴儿中,局部胃肠道暴露和有限的全身性暴露Inmazeb的影响尚不清楚。
Inmazeb治疗扎伊尔埃博拉病毒引起的感染的安全性和有效性已经在出生到18岁以下的儿童患者中得到证实。Inmazeb用于这一适应症得到了试验数据的支持,试验包括39名出生在18岁以下的儿科受试者,包括扎伊尔埃博拉病毒感染RT-PCR呈阳性的母亲所生的新生儿。接受Inmazeb治疗的成人和儿童受试者的28天死亡率和安全性相似。另外38名从出生到18岁以下的儿科受试者在扩大准入计划中接受Inmazeb治疗。
Inmazeb的老年使用临床研究没有包括足够数量的65岁及以上的受试者,以确定他们的反应是否与年轻受试者不同。在随机对照试验中接受Inmazeb治疗的154名扎伊尔埃博拉病毒感染者中,有5人(3.2%)年龄在65岁或以上。有限的临床经验没有确定老年人和年轻人之间的反应差异。
Inmazeb针对埃博拉病毒表面的糖蛋白,糖蛋白附着在细胞受体上,融合病毒和宿主细胞膜,使病毒进入细胞。Inmazeb的三种抗体可以同时与这种糖蛋白结合,并阻止病毒的附着和进入。
告知患者,在Inmazeb输液期间和输液后报告了包括输液相关事件在内的超敏反应,如果用药时出现任何全身过敏反应症状,请立即就医。
指导感染扎伊尔埃博拉病毒的患者不要母乳喂养,因为有将扎伊尔埃博拉病毒传染给婴儿的风险。
注:药品如有新包装,以新包装为准。以上资讯仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。

